2.3. Einige Beispiele
|
Betrachten wir dazu einige Beispiele, die deutlich machen, wie das Regalmodell die Energiespeicherung darstellt. Zunächst soll die Grundregel erläutert werden. In der folgenden Abbildung sehen Sie drei Regale. 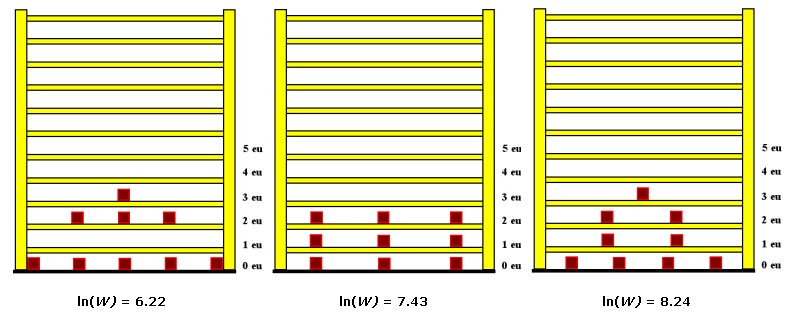
|
|
Betrachten wir dazu einige Beispiele, die deutlich machen, wie das Regalmodell die Energiespeicherung darstellt. Zunächst soll die Grundregel erläutert werden. In der folgenden Abbildung sehen Sie drei Regale. 
|

|
|
Für die Entropie wird häufig die Beziehung S = R . ln(W) angegeben, die auf Ludwig Boltzmann zurückgeht. Da Änderungen der Entropie verständlicherweise nicht von der Konstanten R sondern nur von dem Term ln(W) herkommen können und es häufig auf die Entropieänderungen ankommt, ist es zweckmäßig nur diesen Teil der Beziehung als fundamentale Entropie σ zu bezeichnen, so wie es KITTEL und KRÖMER vorgeschlagen haben. Ein weiterer Vorteil ergibt sich durch den Zusammenhang zwischen Entropie und Temperatur. Auch das Temperaturphänomen wird durch die Festlegung von KITTEL und KRÖMER mit der fundamentalen Temperatur τ = RT wesentlich klarer beschrieben. In den folgenden Abschnitten wird dies näher erläutert. |
|
|
|
|
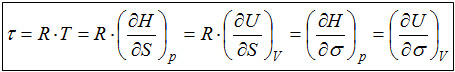
(H: Enthalpie ; U: innere Energie ; |
|
|
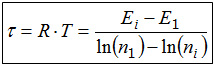
(k: Boltzmann-Konstante ; Ei : Energie des i-ten Niveaus ; ni : Besetzungszahl des i-ten Niveaus) |
|
Ein Vergleich der beiden Temperaturdefinitionen zeigt, dass es sich in beiden Fällen um Quotienten handelt. Da in beiden Fällen im Zähler eine Energiedifferenz steht, kann man schließen, dass auch die Nenner in beiden Fällen eine gleichartige Qualität haben müssen. An der zweiten Temperaturdefinition ersieht man leicht, dass es sich um die Qualität einer Anzahl handelt, denn die Besetzungszahlen der Energieniveaus sind natürliche Zahlen, schließlich kann man keine halben Teilchen im "Regal" einlagern. Durch das Logarithmieren geht der Anzahlcharakter nicht verloren. Wird die Temperatur durch kT oder besser RT* beschrieben, so würde man dies auch an der Einheit kJ/mol erkennen können. Die Anzahlen, auf die die Energie bezogen wird, sind die Anzahlen der Mikrozustände, die das System oder der Stoff mit der entsprechenden Energie annehmen könnte. Die Anzahl der Mikrozustände ist für Substanzen unter alltäglichen Bedingungen so groß, dass sie jedes menschliche Vorstellungsvermögen für Zahlen übersteigt. Für 100g Kochsalz oder 10 Liter Helium ergeben sich Werte in der Größenordnung von 103.1024Stück. Die Anzahl der Mikrozustände nimmt jedoch mit der Anzahl der besetzten Energieniveaus monoton zu. Deshalb ist es zulässig, vereinfachend zu sagen: Die Entropie ist ein Maß für die Anzahl der besetzten Energieniveaus. Und diese Vereinfachung ist auch sinnvoll, denn die Anzahl der besetzten Niveaus liegt in einer anschaulich leicht fassbaren Größenordnung. Für 10 Liter Helium liegt sie im Bereich von ca. 2000 besetzten Niveaus. Eine mathematische Besonderheit der Exponentialfunktion läßt sich nutzen, um die thermodynamische Definition der Temperatur auf der Basis der Energiequantelung zu vereinfachen. Diese Besonderheit liegt darin, dass nach stets gleichen Änderungen der unabhängigen Variablen (hier die Energie) sich die Funktionswerte halbieren. Diese Eigenschaft ist vielen vom radioaktiven Zerfall her vertraut. Dort dient sie dazu, die Schnelligkeit des Zerfalls zu charakterisieren: Man gibt die Halbwertzeit an, denn die unabhängige Variable ist beim radioaktiven Zerfall die Zeit. In völliger Analogie dazu kann man hier von der Halbwertsenergie EH sprechen, also von der zusätzlichen Energiehöhe, nach der sich die Besetzungszahl ni eines Niveaus im Vergleich zu einem Ausgansgniveau n1 halbiert: EH = Ei - E1 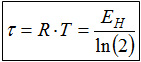
|
* (Der Unterschied zwischen der Boltzmann-Konstanten k und der Gaskonstanten R besteht nur aus einem Einheitenwechsel. Korrekterweise sollte bei einer Einheitenumrechnung auf beiden Seiten des Gleichheitszeichens ein Zahlenwert und ein Einheitensymbol stehen: 1 mol = 6,02214 . 1023 stück. |