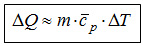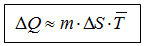3.2. Anwendungen des Fluidmodells
Die Grundversion Bei Flaschen/Gefäßen mit konstantem Querschnitt bestimmt stets die
Querschnittsfläche A das Fassungsvermögen solcher Flaschen/Gefäße
bis zu einer bestimmten Füllhöhe. Übertragen bedeutet dies: 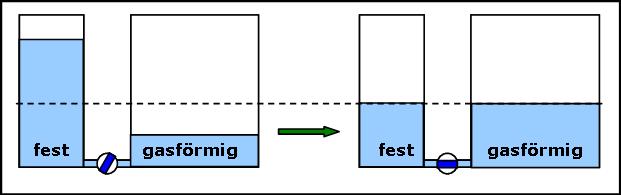 Das obige Bild visualisiert Rechnungen auf der Basis einer der Beziehungen: Im Folgenden zeigen wir, dass man durch verschiedene Stufen der Verfeinerung dieses Modells die recht komplexen thermodynamischen Verhältnisse realer Stoffe sehr differenziert visualisieren und damit verständlich machen kann. *(Je nach dem experimentellen Zusammenhang werden Thermokapazität und Entropie statt auf die Stoffmenge auch alternativ auf die Masse einer untersuchten Stoffportion bezogen, so dass man dann die jeweiligen spezifischen Werte von Entropie und Thermokapazität verwendet.) Die 1. Verfeinerung
Entropie und Thermokapazität tragen beide zur Speicherfähigkeit von stofflichen Systemen bei, aber jeweils auf etwas andere Art. Der Unterschied lässt sich aber sinnvoll ins Fluidmodell integrieren: Entropie und Thermokapazität beschreiben gemeinsam die Speicherkapazität eines Stoffsystems für thermische Energie, also der Energie, die auf den Energieniveaus eines Stoffsystems gespeichert werden kann. Dabei enthält die Entropie die Aussage über die Gesamtenergie, die vom absoluten Nullpunkt bis zur gerade aktuellen Temperatur des experimentellen Kontexts gespeichert wird, während die Thermokapazität die Änderung der Entropie im Verlauf der Temperaturskala, bzw. im Bereich der gerade aktuellen Temperatur angibt. Die folgende Animation verdeutlicht, dass das Fluidmodell gerade die quantentheoretischen Ergebnisse auf dieses Modell überträgt. Während der gezeigten Temperaturzunahme verdreifacht sich die gespeicherte thermische Energie, aber die Entropie nimmt nur auf das 1,5-fache zu. Der Radius des Modellzylinders sogar nur um das 1,2 fache: Animation: Thermische Arbeit im Regal- und im Fluidmodell Die 2. Verfeinerung Beim Betrachten der vorigen Animation fällt der Farbwechsel des fluiden Mediums auf und er erfordert eine Erklärung, welches Phänomen dadurch dargestellt werden soll. 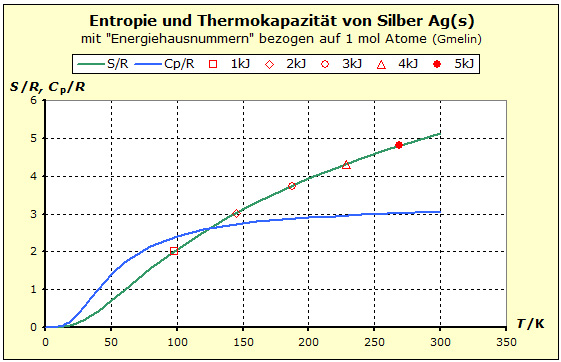 Wir betrachten dazu das obige Diagramm, das die Entropie- und Thermokapazität-Messwerte von Silber darstellt [s. 8.2/12 Gmelin-Handbuch]. 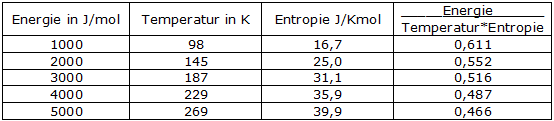 Da der Quotient mit zunehmender Temperatur kleiner wird, muss man also feststellen: 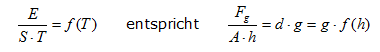 Bei normalen Flüssigkeiten gehen wir davon aus, dass die Dichte nicht von der Füllhöhe anhängig ist. Anders verhält es sich bei den ebenfalls fluiden Gasen: d = f(h), und zwar genau so, dass die Dichte mit zunehmender Höhe nach der Barometerformel abnimmt. Wenn wir uns unter dem fluiden Modellmedium jetzt ein dichtes Gas vorstellen, so können wir dem realen thermodynamischen Befund auch im Modell entsprechen. Wir vereinfachen jedoch auch hier, indem wir die Dichte über die gesamte Füllhöhe mitteln und diese mittlere (Speicherungs-)Dichte durch unterschiedliche Farbintensität im Fluidmodell darstellen. Wir haben hier das Fluidmodell aus dem thermodynamischen Verhalten von Silber entwickelt. Es soll jetzt noch gezeigt werden, dass dies kein Sonderfall des Silbers ist, sondern dass es sich um allgemeines, thermisches Phänomen handelt. .gif) Das Diagramm zeigt das thermische Verhalten einer ganze Palette von Feststoffen: eine polare molekulare Verbindung (H2O), eine salzartige Ionenverbindung (NaCl), ein unpolares molekulares Elemente (Br) und ein Metall (Pb) [s. 8.2/12 Gmelin-Handbuch]. Man erkennt auch hier, dass die "Energiehausnummern" zunehmend näher zusammenrücken. Wir haben jetzt in diesem Diagramm die Achsen so gewählt, dass die Temperatur als abhängige Variable erscheint. Dadurch wird besser deutlich, dass es bei Stoffen mit großen Entropien mehr thermische Energie erfordert, um sie auf entsprechend hohe Temperaturen zu bringen, dass es sich also bei solchen Stoffen um thermisch träge Stoffe handelt. So wird Eis (1 mol Atome) mit der thermischen Arbeit von1 kJ auf 200K erwärmt, während man 1 mol Bleiatome mit dieser Arbeit nur auf etwa 70 K bringen kann und dass man mehr als 4 kJ benötigen würde, um nur in die Nähe von 200K zu kommen. Die 3. Verfeinerung Der Zylinder unseres Modellspeichersystems hat zwei Zuflussmöglichkeiten. Diese benötigen wir, um die beiden grundsätzlich verschiedenen Arten der Temperaturänderungen wiederzugeben: Auch die oben erwähnte Temperatursteigerung ohne Entropiezunahme läßt sich mit dem Fluidmodell darstellen. Bleibt die Entropie trotz Energiezufuhr konstant, so bedeutet dies im Modell, dass die Querschnittsfläche gleich bleibt. Die Wände geben also dem hydrostatischen Druck, der ja trotzdem mit der Füllhöhe steigt, nicht mehr nach. Sie werden also massiver und damit standfester. Dies wird hier durch zunehmende Intensität der Wandfarbe von hellgrau nach dunkelgrau symbolisiert. Schauen
Sie sich auch die Visualisierung dieses Sachverhalts im Fluidmodell an: Die Animation zeigt, dass alle Niveaulinien waagerecht parallel verschoben werden, dass also alle Besetzungszahlen gleich bleiben und nur die Niveauabstände größer werden. Als Folge dieser größeren Niveauabstände wird auch die blaue Halbwertsenergielinie länger, also die Temperatur höher. Wenn kein Teilchen das Niveau wechselt, ist das ein Zeichen dafür, dass bei diesem Arbeitsprozess keine elektrischen Wechselfelder mitwirken. Die Temperaturänderung mittels mechanischer Arbeit, Volumenarbeit, hat also andere physikalische Ursachen. Dieser andere Hintergrund macht es erforderlich, dass man thermodynamisch zwischen Volumenarbeit und allen Nicht-Volumenarbeiten unterscheiden muss. Die beiden Grundvorgänge des ersten Hauptsatzes lassen sich natürlich auch mit dem Regalmodell allein darstellen. Es ist das grundlegendere Modell, dessen Berechnungen dann im Fluidmodell graphisch und anschaulich umgesetzt werden. Beide zusammen vermitteln einen sehr plastischen Eindruck von den thermodynamischen Phänomenen. |
Die 4. Verfeinerung Diese Verfeinerung führt uns auf ein den Hochschulen angemessenes Niveau. Atomare Gase können nach klassischer Vorstellung nur Translationsbewegungen in drei Raumrichtungen ausführen. Jedes Gasatom stellt drei Freiheitsgrade für die Speicherung thermischer Energie zur Verfügung, je einen in x-, y- und z-Richtung. Quantentheoretisch stellt ein Freiheitsgrad ein Eigenwertsystem mit unendlich vielen gequantelten Energieniveaus dar. Die energetischen Abstände dieser Niveaus folgen bestimmten Gesetzmäßigkeiten, in die die Massen der Gasatome, die zwischen ihnen wirkenden Kräften und die Größe des Raumes eingehen. (s. Abschnitt 2.4) Ein einzelnes Gasatom befindet sich zu einem bestimmten Zeitpunkt in jeweils einem dieser Zustände des x- , y- und z-Eigenwertsystems. Die Zustände in den verschiedenen Raumrichtungen können gleich oder unterschiedlich hoch angeregt sein.  In der klassischen Vorstellung können zweiatomige Moleküle um zwei Drehachsen rotieren und sie können gegeneinander schwingen. Die beiden Drehachsen liegen senkrecht zueinander und senkrecht zur Molekülachse, in der die Schwingung erfolgt. * Auf die Implementierung einer vierten Speicherung, nämlich der Speicherung thermischer Energie in den Elektronenzuständen, wird hier verzichtet, weil sie bei den meisten Stoffen keinen Beitrag zur Entropie und damit zum thermischen Verhalten der Stoffe beisteuert. Damit haben wir drei unterschiedliche Arten von Speichern für thermische Energie kennengelernt und wenden uns jetzt dem Zusammenwirken dieser Speicher in verschiedenen Fällen zu, d. h. wir konzentrieren uns jetzt auf das Verhalten der molekularen Gase zunächst bei thermischer Arbeit und dann bei Volumenarbeit. Als Beispiel für ein molekulares Gas nehmen wir Bromdämpfe erwärmen sie mit thermischer Strahlung (aus einem Brenner oder von einem elektrisch beheißtem Draht) von der Standardtemperatur bis auf 500K. Die beiden folgenden Bilder zeigen die drei Speichersysteme im Fluidmodell, links bei Standardtemperatur und rechts bei 500K. Die Basisleitung verbindet die drei Speicherbehälter, so dass sie sich physikalisch wie klassische, verbundene Gefäße verhalten. |
|
Erwärmung von Br2(g) durch thermische Arbeit .png)
Man erkennt leicht, dass in allen drei Speichern der Pegelstand, also die Temperatur, sowie die Menge an fluidem Medium, also thermischer Energie, größer geworden ist. Schwieriger ist es zu sehen, dass auch die Entropie, also die Querschnittsflächen, zugenommen haben. Am besten ist es noch am Vibrationsspeicher zu erkennen, da hier die Fläche sehr klein und damit die Zunahme prozentual recht groß, ca. 75%, ausfällt. (Translation +5,4%, Rotation +5,9%) Die Darstellung wurde vom Thermulation-II Programm berechnet und man muss bedenken, dass durch die Auflösung des Bildschirms bedingt, die prozentuale Veränderung eventuell unter einem Pixel bleibt, so dass der Bildschirm sie nicht anzeigen kann. Erwärmung von Br2(g) durch Volumenarbeit .png)
Auch hier erkennt man, dass Temperatur und thermische Energie in allen drei Speichern zugenommen haben. Zu erwarten wäre eigentlich, dass sich die Volumenarbeit nur auf den Translationsspeicher auswirkt, weil nur diese Eigenwerte vom Volumen abhängen. Allerdings würde sich durch eine Volumenarbeit dann im Translationsspeicher eine andere Temperatur einstellen als in den beiden anderen Speichern. Da das schwer vorstellbar ist, sollten wir einen Mechanismus suchen, mit dem die thermische Energie vom Translationsspeicher auf die beiden anderen übertragen wird. |