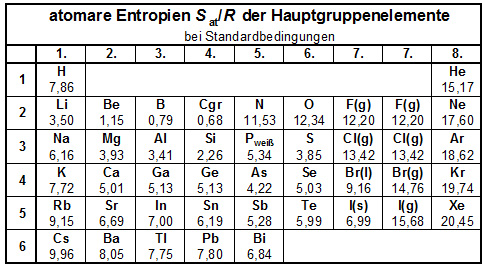
|
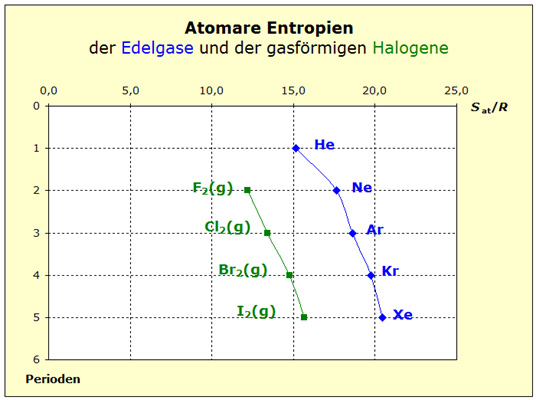
Die Halogene sind bei Standardbedinungen nicht alle gasförmig. Jedoch ist die Umwandlung in den Gaszustand sowohl bei Brom wie auch bei Jod leicht durchführbar, so dass wir in den offiziellen Tabellen die Werte für die gasförmigen Halogene auch bei Standardbedinungen finden. Damit können wir die gasförmigen Halogene sehr gut mit den Edelgasen vergleichen. Die mit der Periode zunehmenden Entropiewerte finden wir auch bei den gasförmigen Halogenen und zwar aus demselben Grund: Zunahme der Atommassen. Allerdings liegt die Kurve insgesamt bei niedrigeren Werten. Daraus erkennen wir, dass jedes Halogenatom durch die Bindungskraft der unpolaren Atombindung in seiner Bewegungsmöglichkeit eingeschränkt ist. Nach der Kraftregel führen größere Kräfte zu kleineren Entropien. Masse- und Kraftregel machen diese Phänomene verständlich. Eine detaillierte Diskussion über die für die Stoffeigenschaft 'Entropie' wichtigen Kräfte finden Sie hier: |
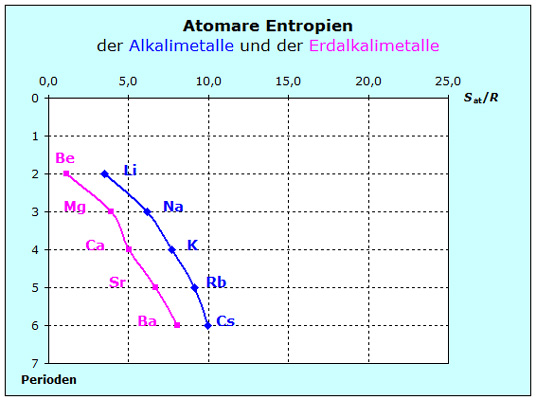 Beim Vergleich der Entropien der 1. und 2. Hauptgruppe des PSE scheint auf den ersten Blick alles ähnlich zu sein wie beim Vergleich von Edelgasen und Halo-genen.
Beim Vergleich der Entropien der 1. und 2. Hauptgruppe des PSE scheint auf den ersten Blick alles ähnlich zu sein wie beim Vergleich von Edelgasen und Halo-genen.