|
Ähnlich wie bei den Elementen wollen wir auch hier mit den Nichtmetallen beginnen und die Wasserstoffhalogenide mit den Halogenen vergleichen. Beide Stoffarten bestehen aus zweiatomigen Molekülen und die Tabellenwerke enthalten für beide die Standardentropien im Gaszustand. Dies macht den Vergleich einfach.
|
|
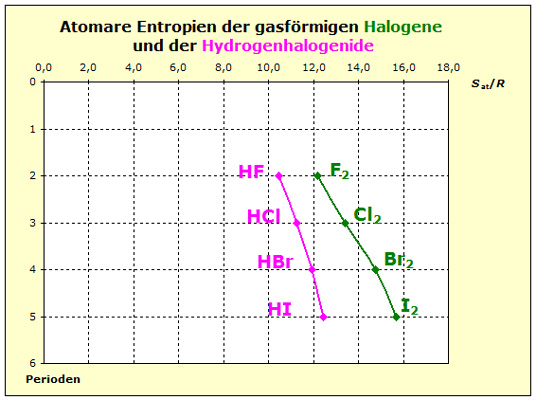 Es treten zwei wichtige Unterschiede auf:
Es treten zwei wichtige Unterschiede auf:
1. die Bindungsarten
2. die Teilchenmassen
Wegen der Differenz der Elektronegativitätswerte in den Wasserstoff-Halogen-Verbindungen treten hier polare Atombindungen auf und die Teilchen unterliegen in diesem Fall stärkeren Kräften als bei den reinen, unpolaren Halogenen.
Da Wasserstoffatome eine wesentlich geringere Masse haben als die Halogen-atome, nimmt die Teil-chenmasse gegenüber den jeweiligen Halogenen ab.
Beide Effekte bewirken, dass die Entropiewerte der Wasserstoffhalogenide kleiner sind als die der reinen gasförmigen Halogene.
|
|
Betrachten wir nun einfache Verbindungen der Metalle, also Salze wie z. B. die Chloride der Alkali- und Erdalkalimetalle. Diese Stoffe sind uns z. T. aus dem alltäglichen Leben bekannt wie das Natriumchlorid, das wir unter anderem als Kochsalz kennen. Andere kennen wir aus dem naturwissenschaftlichen Unterricht wie Kaliumchlorid oder Magnesiumchlorid. Von den Stoffen wissen wir, dass sie beim Raumtemperatur fest und kristallin sind. Die Kristalle sind hart und spröde. Wegen dieser Eigenschaft wird Natriumchlorid auch Steinsalz genannt. Diese Eigenschaften deuten hin auf große Kräfte und kleinere Entropien als bei den oben diskutiertten gasförmigen Stoffen.
|
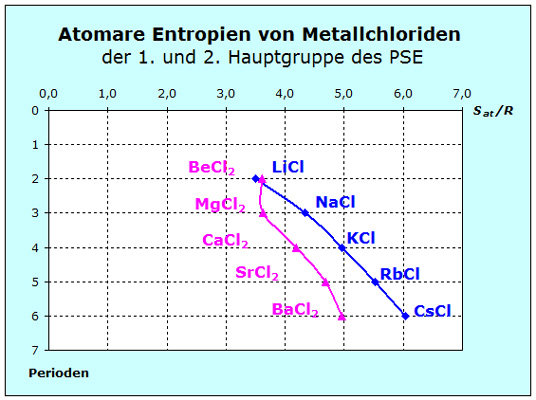 Wir müssen wieder zwei Fragen klären: Wir müssen wieder zwei Fragen klären:
1. Welche Kräfte treten auf?
2. Wie groß sind die Teilchenmassen?
Die beiden Stoffgrupen unterscheiden sind in ihrer Stöchiometrie und deshalb vergleichen wir ihre atomaren Entropien.
Zweifach positiv geladene Erdalkaliatome bewirken größere Kräfte, die kleinere Entropien zur Folge haben. Das Diagramm zeigt eines Ausnahme: Berylliumchlorid
|
|
|
Um diese Abweichung zu verstehen, betrachten wir zwei weitere Diagramme. Eines zeigt die Differenzen der Elektronegativitätswerte dieser Salze und das andere die Bindungsabstände.
|
|
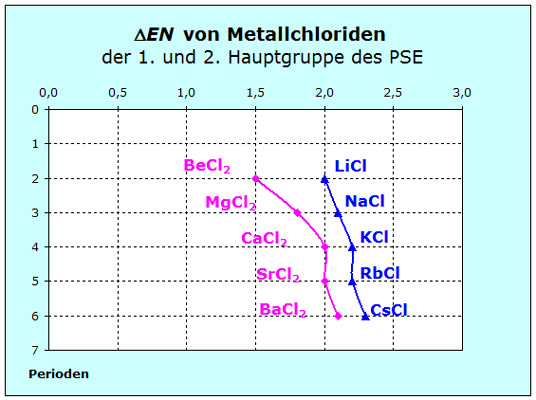 Die Differenzen der Elek-tronegativitäten fallen - wie zu erwarten - bei den Chloriden der 2. Haupt- gruppe kleiner aus. Die Differenzen der Elek-tronegativitäten fallen - wie zu erwarten - bei den Chloriden der 2. Haupt- gruppe kleiner aus.
Beim Berylliumchlorid ist der Wert mit 1,5 bereits so klein, dass man nicht mehr von einer Ionenbindung spricht. Also rechnen wir mit kleineren Kräften und deshalb mit einem größeren Entropiewert.
Da die Massen der Erdalkaliatome nur ca. 9% größer sind als die der Alkalimetalle, spielt der Einfluss der Masse keine so große Rolle. Die kleineren Entropiewerte sind eine Folge der größeren Kräfte.
|
|
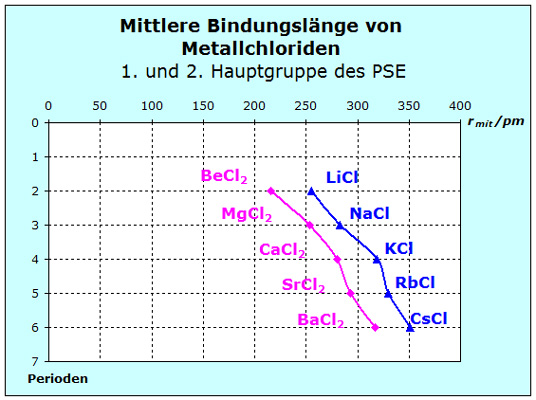
Ein Blick auf das Dia- gramm, das die unter- schiedlichen Bindungsab- stände zeigt, bestätigt die bisherige Deutung der En- tropiewerte sogar mit der Ausnahme des Beryllium- chlorids. Der Bindungs- abstand ist im Vergleich mit den anderen Stoffen relativ groß, also sind auch die Kräfte unsystematisch klein und damit die Entropie groß.
|
 Es treten zwei wichtige Unterschiede auf:
Es treten zwei wichtige Unterschiede auf: Wir müssen wieder zwei Fragen klären:
Wir müssen wieder zwei Fragen klären: Die Differenzen der Elek-tronegativitäten fallen - wie zu erwarten - bei den Chloriden der 2. Haupt- gruppe kleiner aus.
Die Differenzen der Elek-tronegativitäten fallen - wie zu erwarten - bei den Chloriden der 2. Haupt- gruppe kleiner aus.