|
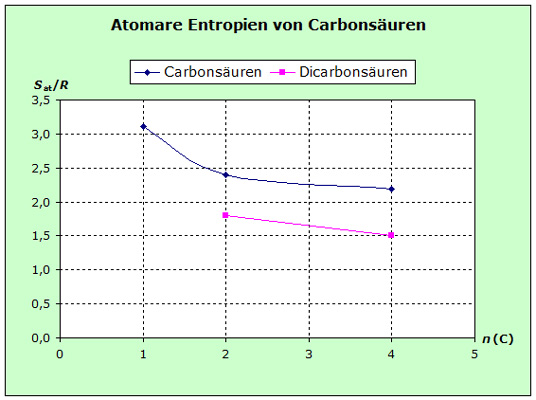
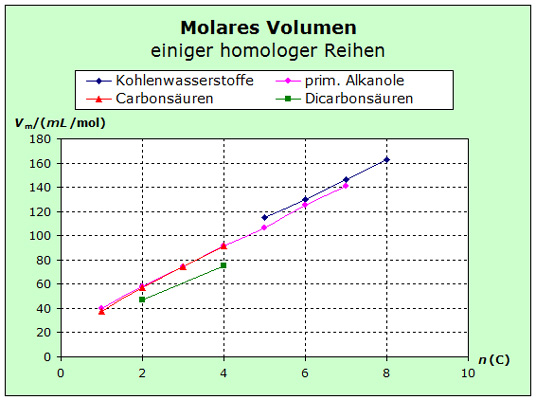
Die atomaren Entropien von organischen Verbindungen und die von salzartigen Stoffen zeigen ein deutlich unterschiedliches Verhalten. Ursache dafür sind die unterschiedlichen Kräfte des inneren Zusammenhalts. |
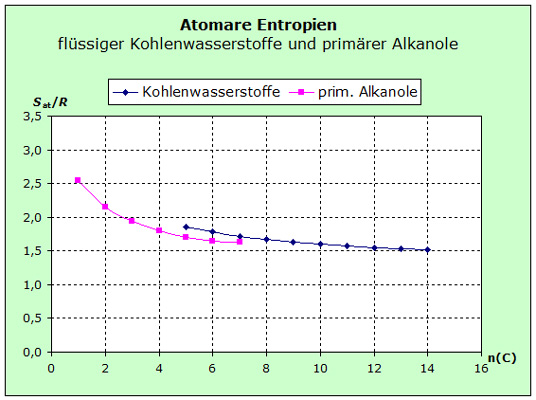 |
Die Abnahme der atomaren En-tropien der gesättigten flüssigen Kohlenwasserstoffe von Pentan bis Octan zeigt, dass in diesen Stoffen mit zunehmender Anzahl der C-Atome die Kräfte, die zwischen den Molekülen wirken, größer werden. |
|
Eine zusätzliche alkoholische OH-Gruppe bewirkt beim Hexanol (6 C-Atome) eine Absenkung der Entropie gegenüber dem Hexan: Hexan - Sat/R = 1,77 Das zusätzliche Sauerstoffatom in Hexanol erhöht die atomare mittlere Masse um etwa 13%, was einen höheren Entropiewert verursachen würde. Allerdings ist die polare OH-Gruppe mit größeren van-der-Waals-Kräften verknüpft, die die Entropie senken würden. Die Messwerte zeigen, dass der Einfluss der Kräfte offensichtlich von größerer Bedeutung ist als der Einfluss der durchschnittlichen Masse. Die Kraftregel hat Vorrang vor der Massenregel und wurde deshalb vor der Masseregel angegeben. |
|
 |
|
 |
|