7.4. Thermodynamischer Antrieb bei chemischen Reaktionen
In diesem Abschnitt geht es darum, aufzuzeigen, dass der Antrieb für eine chemische Reaktion sich auf das gleiche Grundphänomen zurückführen lässt wie der Antrieb, der zum Temperaturausgleich zwischen einem heißen und einem kalten Stoffe führt, so wie er hier in Abschnitt 6.3 vorgestellt wurde. Die vier Grundfragen zum Antrieb bleiben auch in diesem Abschnitt aktuell und wir werden am Ende dieses Kapitels feststellen, ob unsere Antworten hier bei den chemischen Reaktionen anders ausfallen als beim Temperaturausgleich. |
Video mit Ton: Modellversuch zur Einstellung eines Gleichgewichts, Hinreaktion |
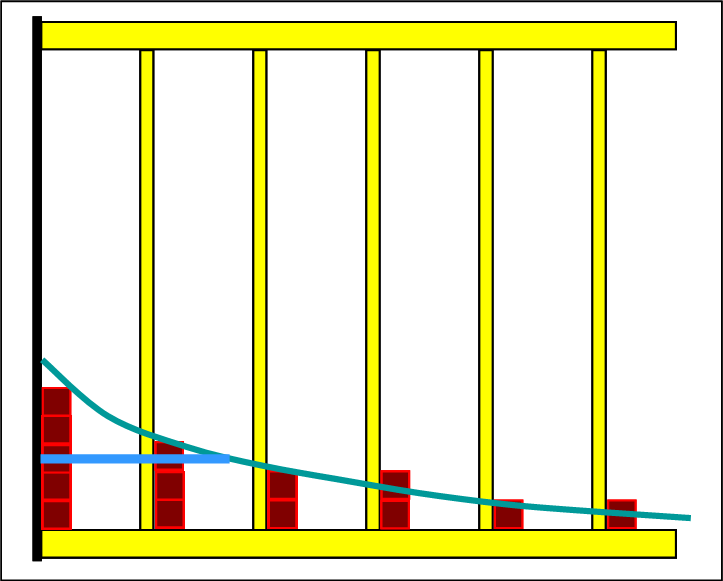
Die beiden folgenden Bilder zeigen noch einmal den Ausgangszustand der Edukte und den Endzustand des eingestellten Gleichgewichts. Da die Linien der Halbwertsenergien skizziert sind, erkennt man gut, dass sich das Gleichgewicht auf endothermen Weg eingestellt hat. |
|
 |
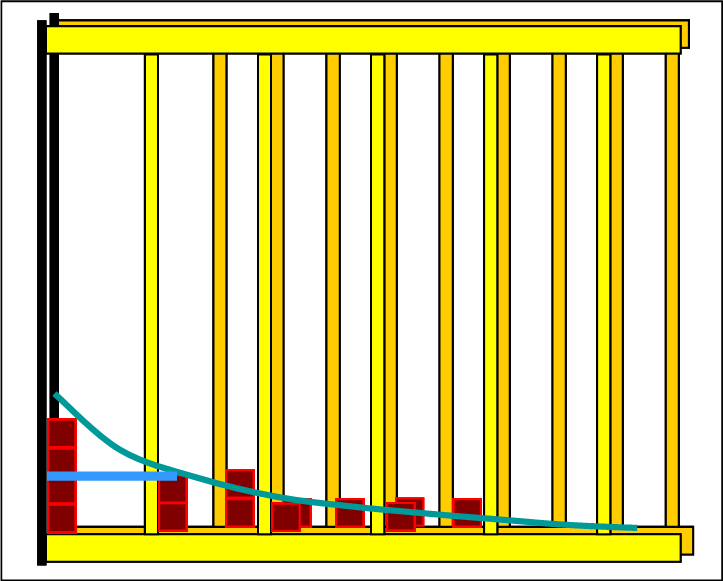 |
Auf der Eduktseite sind 6 Niveaus besetzt und im Gleichgewicht verteilen sich die Teilchen auf 9 Niveaus. Das ist ein Hinweis darauf, dass die Entropie zugenommen hat. Die Art und Weise wie in den einzelnen Schritten das Endstoffregal aufgefüllt und aus dem Eduktregal entnommen wird, entspricht genau der Grundregel. Jede neu entstehende Verteilung ist "boltzmannartig". Mit dem Programm Thermulation-I kann man zeigen, dass in jedem Teilschritt die Halbwertsenergie bei Edukten und Produkten gleich ist. |
|
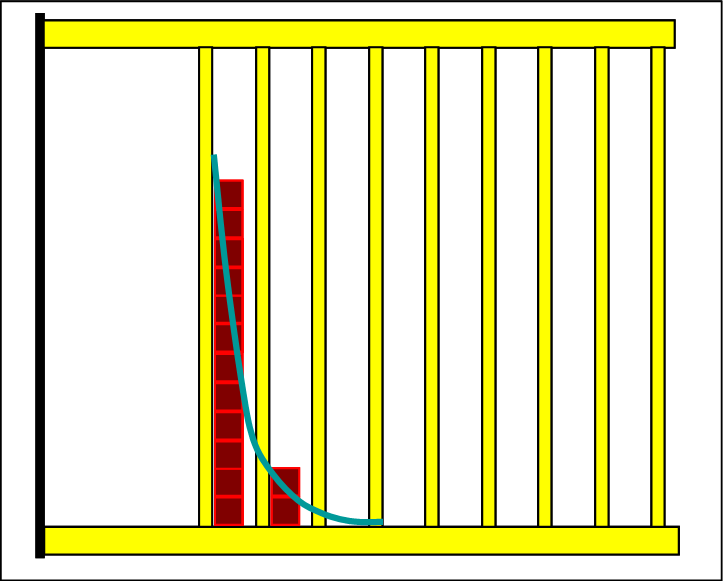 |
Da jetzt das unterste Niveau deutlich über dem Nullniveau des Gesamtsystems liegt, werden die Teilchen auf die zwei untersten Niveaus der Produktseite zusammen gedrängt, weil die Gesamtenergie zu klein ist, um noch höhere Niveaus zu besetzen. Dieser Zustand würde sich aus der Eduktseite nicht spontan und freiwillig einstellen. Es sind nur zwei Niveaus besetzt, mithin ist die Entropie sehr gering und unsere Erfahrung lehrt uns, dass die natürlichen Prozesse nicht über das Entropiemaximum hinaus freiwillg erfolgen. |
Wenn man aber einmal den Endstoff auf anderem Weg gewonnen hat, so kann man ihn auf diese Temperatur abkühlen. Dann kann man feststellen, dass dieser Stoff spontan und freiwillig die exotherme Rückreaktion antritt, natürlich nur falls keine kinetische Hemmung vorliegt. |
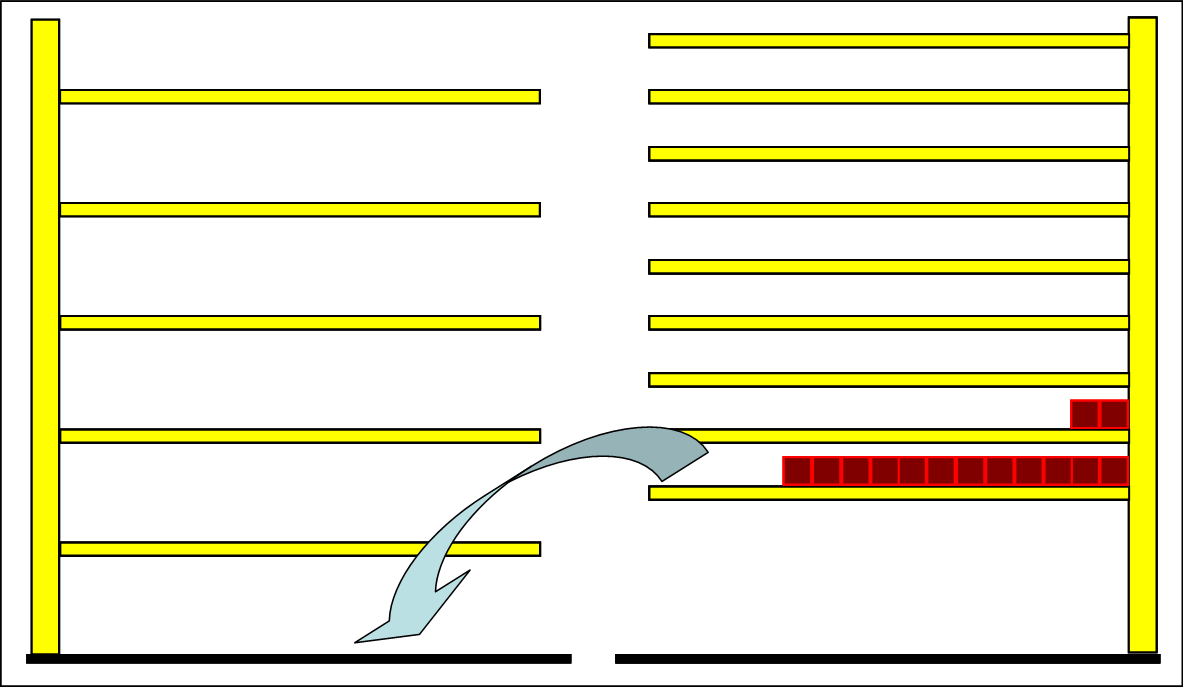 |
Wenn Teilchen bei der Reaktion nach unten fallen, so müssen wegen der Energieerhaltung auch einige in höhere Niveaus angehoben werden. Dies leisten die Photonen, die beim Übergang in die unteren Niveaus emittiert werden, aber wegen der Isolation das System nicht verlassen, stattdessen aber die eigenen Systemteilchen auf höhere Niveaus bringen. Die Teilchen werden auf mehr als zwei Niveaus verteilt und die Halbwertsenergie, also die Temperatur steigt. Die Rückreaktion ist exotherm. |
Zum Schluss des Abschnitts über den Antrieb bei chemischen Reaktionen wollen wir wieder kontrollieren, wie wir die vier Fragen zum Antrieb, die wir in 6.3 gestellt haben, jetzt beantworten können.
Die Edukte liegen in einem Makrozustand mit einer bestimmten dominanten Verteilung vor. Durch die Aufhebung der kinetischen Hemmung wird jedoch eine andere Verteilung der thermischen Gesamtenergie im Gesamtsystem dominant, weil weitere, bisher unbesetzte Niveaus jetzt plötzlich erreichbar werden. Liegen diese Niveaus bei einer niedrigeren Energiehöhe, so wechseln Teilchen unter Emission von Photonen in diese Niveaus. Ist das System isoliert, so bleiben die Photonen im System und es können andere Teilchen unter Absorption dieser Photonen auch in höhere unterbesetzte Niveaus wechseln.  |
Wir können nun die Anworten auf die vier Fragen zum thermodynamischen Antrieb bei Temperaturausgleich und chemischer Reaktion zusammenfassen: |